2025年4月21日,Cell杂志在线发表题为“Tissue geometry spatiotemporally drives bacterial infections”的研究论文,动科/动医学院青年教师刘晓晔副教授,作为共同第一作者(排名第二),北京农学院作为合作单位(排名第三)。
该论文揭示了基于多学科交叉的创新设计揭示了宿主组织几何特性影响细菌感染的新模式。该研究发现细菌在上皮组织中的分布并非传统认为的随机模式,而是呈现出明显的“边际效应”,即细菌倾向于感染组织细胞单层边缘牵引力大的区域。在此过程中,力敏感的离子通道蛋白Piezo1在介导细菌感染模式形成的过程中发挥了重要调控作用。该研究揭示了“组织细胞单层几何结构特性-力信号转导-感染识别”主导的病原菌-宿主互作新模式,为开发针对多重耐药菌的宿主导向抗菌疗法提供了新的思路和策略。

打破传统认知:宿主组织几何特性驱动细菌感染”边际效应”的形成
关于细菌和宿主细胞相互作用的研究通常在非限制的上皮单层内进行,且细菌在上皮单层上的分布模式默认为是随机的。该研究打破了传统认为细菌感染是随机分布的观点,表明宿主细胞单层的结构特性对细菌感染的空间分布具有重要调控作用。研究者们基于微纳加工技术构建了具有不同几何结构的上皮单层模型,观察到多种病原菌均在感染初期呈现出边缘分布模式,即呈现出细菌感染的“边际效应”(图1)。该感染模式不受细胞类型、细胞单层尺寸和基底修饰方法等因素的调控,而是与组织细胞单层的致密度相关,即细菌感染主要发生在致密细胞单层的边缘。
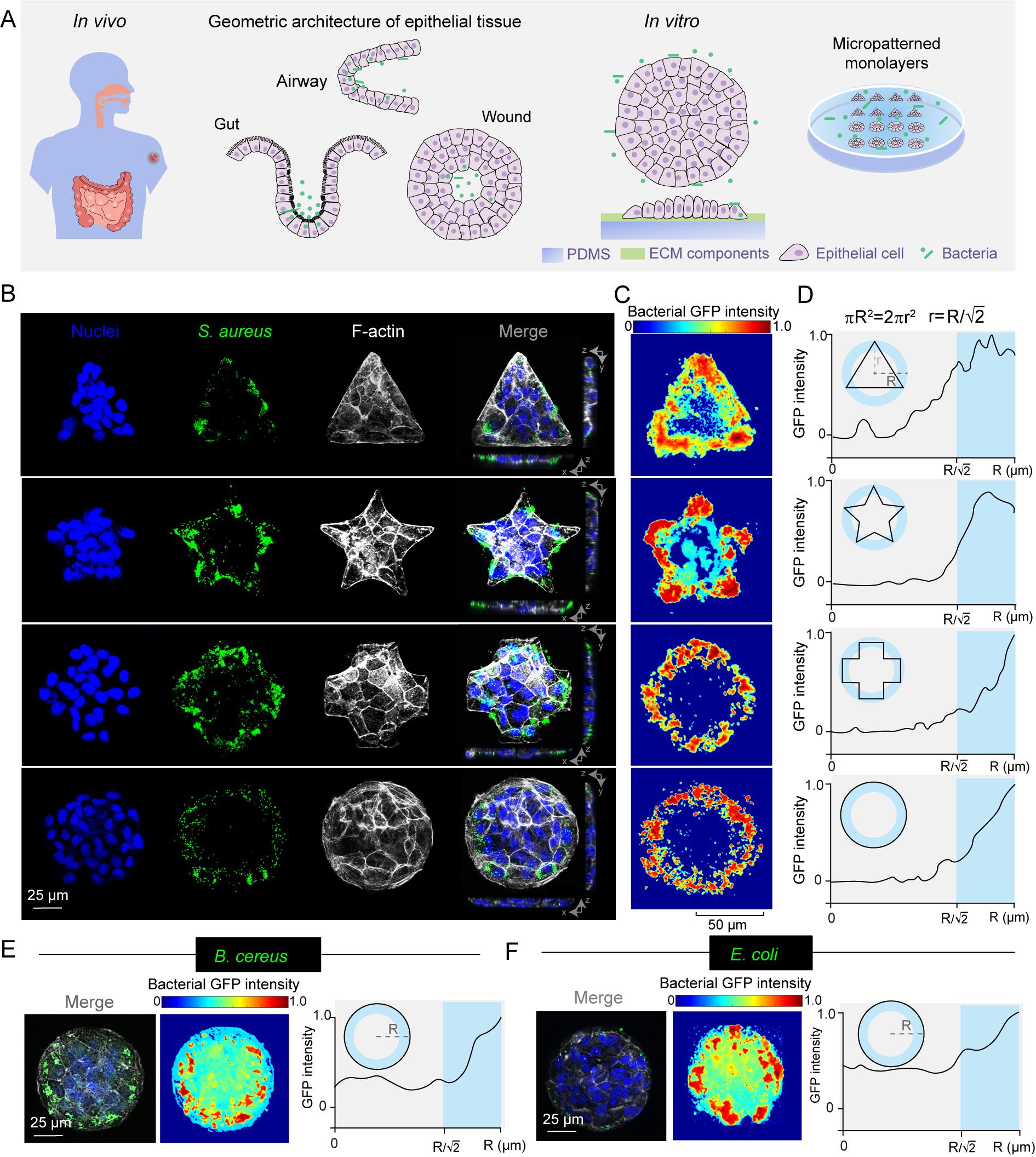
图1:细菌感染多细胞单层呈现的“边际效应”
生物学-力学融合:宿主组织细胞几何结构边际的“生物力-感染”效应
为了解析细菌与宿主细胞单层互作及感染的时空分布规律,研究团队构建了上皮细胞单层与细胞外基质微环境相互作用的生物力学模型,揭示了具有几何约束的上皮单层内细胞牵引力与细菌感染具有高度协同性,即细菌更倾向于感染具有高牵引力区域的细胞,这一发现为理解细菌感染的空间选择性提供了新的视角。在此基础上,研究团队揭示了力敏感的离子通道蛋白Piezo1在细菌与上皮细胞单层互作过程中的关键调控作用。具体而言,在细菌入侵宿主细胞的过程中,Piezo1组装成囊泡状结构,并在细菌入侵部位聚集,进而促进细菌感染“边际效应”的形成。上述工作不仅揭示了力学生物学因素在细菌感染过程中的关键调控作用,也为从生物物理力学视角开发宿主导向型抗感染疗法提供了全新的思路和策略。
力学生物学转导机制:Piezo1蛋白介导细菌感染模式的形成
Piezo1作为经典的力敏感离子通道蛋白,可通过感知和响应细胞外的力学刺激,激发细胞内的力信号转导通路,从而调控细胞的生理功能和行为。研究团队发现,在非感染和感染的几何限制细胞单层中,Piezo1的空间异质性分布均受到细胞牵引力的调控作用。在细菌感染宿主组织细胞过程中,研究团队进一步揭示了Piezo1在高牵引力区域被有效富集和激活,并与入侵细菌发生明显的共定位,随后,通过Ca2+内流信号促进细菌入侵部位p-MLC的组装,从而加速细菌在该区域的感染,形成具有边际效应的感染模式(图2)。

图2:宿主细胞单层结构调控细菌感染示意图
器官特性指导精准给药:基于宿主导向的新型抗菌策略研究
基于力敏感离子通道蛋白Piezo1在介导多细胞上皮单层内产生的细胞牵引力调控细菌感染过程中的关键作用,研究团队尝试将Piezo1作为抗菌靶点,并发现抑制Piezo1的表达和激活均能明显降低感染组织中的细菌载量。进一步,研究团队通过建立仿生3D肠道芯片,成功模拟了具有隐窝等关键形态特征的宿主肠道细胞结构,观察到消化道细菌倾向于在隐窝结构中富集,并发现这一分布模式与Piezo1的激活密切相关。基于这一发现,团队开发了靶向隐窝结构的“核-壳”药物递送系统。通过模拟细菌的分布规律,该药物递送系统不仅能够在物理空间上精准靶向感染位点,还能提升抗菌药物在隐窝结构的局部浓度,提高对MRSA和VRE感染的疗效,为抗菌药物提质增效、降低毒副作用和指导合理用药提供了潜在方案。
总之,本文揭示了“组织细胞单层几何结构特性-力信号转导-感染识别”主导的病原菌-宿主互作新模式,提出了以Piezo1介导的力信号转导通路为潜在靶点的抗菌思路和策略,为开发针对多重耐药菌的宿主导向抗菌疗法奠定了基础,具有重要的临床应用前景。
论文链接:https://www-sciencedirect-com-s.webvpn.bua.edu.cn/science/article/pii/S0092867425003940?via%3Dihub