近日,北京农学院动物科学技术学院王相国副教授课题组在《国际生物大分子杂志》(International Journal of Biological Macromolecules)上在线发表了题为《CREG1靶向结合IGF2R促进牛胎盘滋养层细胞外泌体的形成与释放并伴随外泌体运输参与胎盘类器官的分化调节》(CREG1 promotes bovine placental trophoblast cells exosome release by targeting IGF2R and participates in regulating organoid differentiation via exosomes transport)的研究论文。

胎盘是哺乳动物妊娠期间连接胎儿和母亲的纽带。胎盘的正常生长和功能发挥是保证妊娠成功的关键。反复流产、胎儿生长受限、子痫前期等妊娠常见病均与胎盘早期发育缺陷有关。滋养层细胞是胎盘组织重要的组成细胞,通过分化为不同功能的细胞类型建立胎儿与母亲之间的有效接触。因此,胎盘滋养层细胞的早期增殖和分化是胎盘形成的关键事件,且受多种基因的调控。
外泌体是妊娠期胎盘细胞分泌的一种细胞间通讯介质,其发生和释放受多种分泌糖蛋白的调控。CREG1是一种广泛表达于机体各器官组织的分泌型糖蛋白,具有抑制细胞增殖、促进细胞分化的作用。IGF2R是一种由母体等位基因编码的跨膜多功能糖蛋白,位于细胞表面,同样参与调节细胞生长和分化。研究证实,CREG1通过与IGF2R结合抑制人胚胎癌细胞的增殖。此外,CREG1还参与内吞作用和内体溶酶体的分选和转运进程。
奶牛胎盘属于子叶型胎盘,由胎儿尿囊绒毛膜和羊膜绒毛膜形成的子叶和子宫内膜上皮形成的子宫肉阜两部分组成胎盘丛。研究团队发现,在奶牛胎盘早期发育过程中,CREG1、IGF2R和外泌体标记蛋白主要表达在胎盘子叶滋养层细胞中,表达量随着妊娠月份的增加而增加。过表达Creg1基因增强了胎盘滋养层细胞来源外泌体的发生和释放,而敲低Igf2r基因的表达不仅抑制了外泌体的发生,还抑制了Creg1基因过表达诱导的外泌体的发生和释放。因此,IGF2R不仅是CREG1正向结合蛋白可以通过反馈调节方式调节CREG1的表达。研究团队同时发现,IGF2R能够与Rab11结合,进而促进胎盘滋养层细胞外泌体的形成和释放。

图1 CREG1靶向结合IGF2R调控外泌体的发生和释放
研究团队进一步研究证实,富含CREG1的外泌体添加入基于原代胎盘滋养层细胞构建的类器官培养基质中,至牛胎盘类器官培养的第15天,牛原代胎盘滋养层细胞衍生的类器官出现了明显的细胞分化迹象。转录组分析发现,在胎盘滋养层细胞类器官中加入富含CREG1的外泌体改变了类器官中基因的表达模式,包含胞吞作用、PI3K-Akt信号通路、氧化磷酸化、蛋白质分解和吸收、内质网蛋白质加工、移植物排斥反应等。
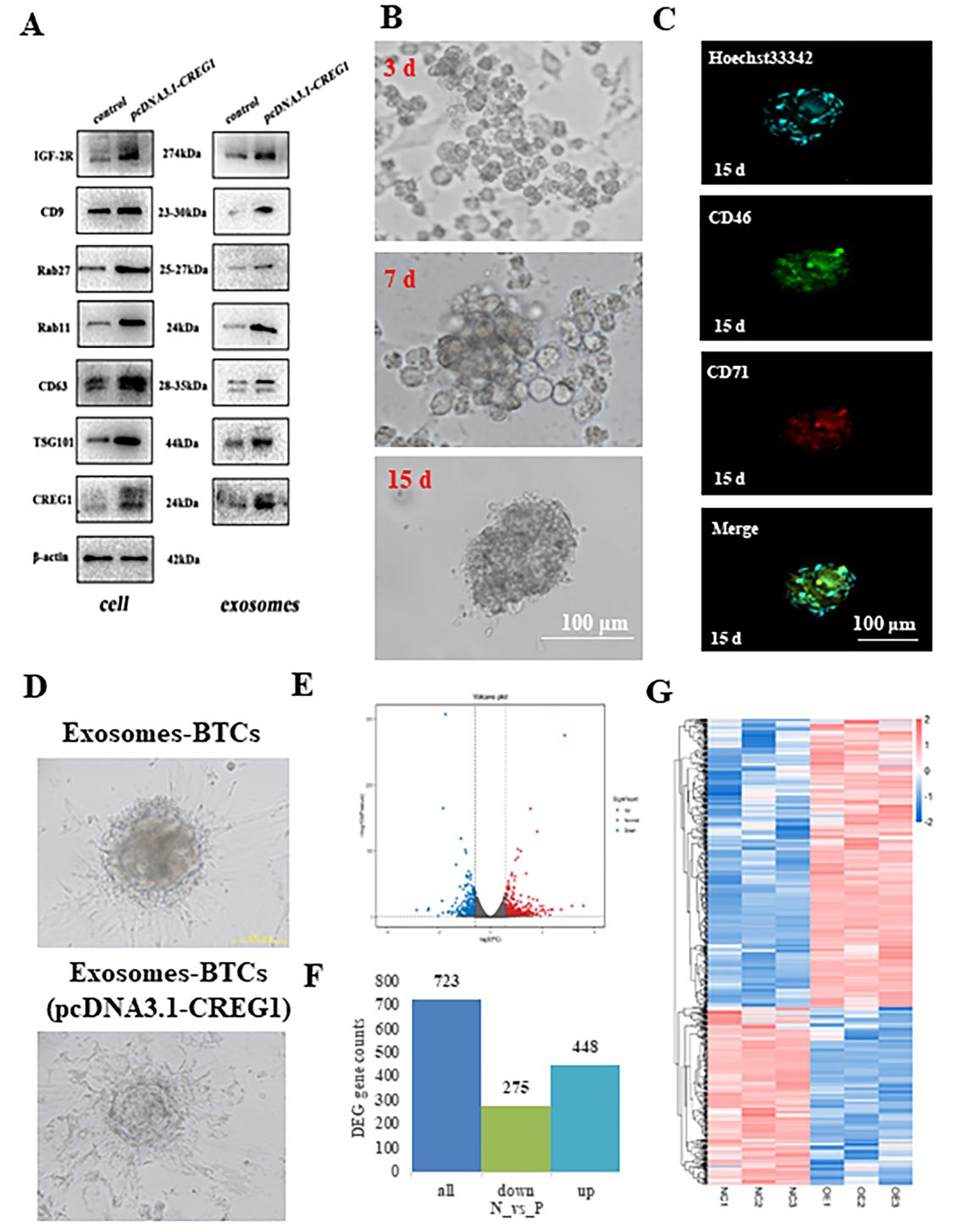
图2 CREG1调节外泌体的发生和释放促进牛胎盘滋养层细胞衍生类器官的分化
本研究初步阐明了CREG1调控牛妊娠早期胎盘滋养层细胞增殖分化的机制,为胎盘早期发育缺陷的诊断和治疗提供了理论和实践依据。
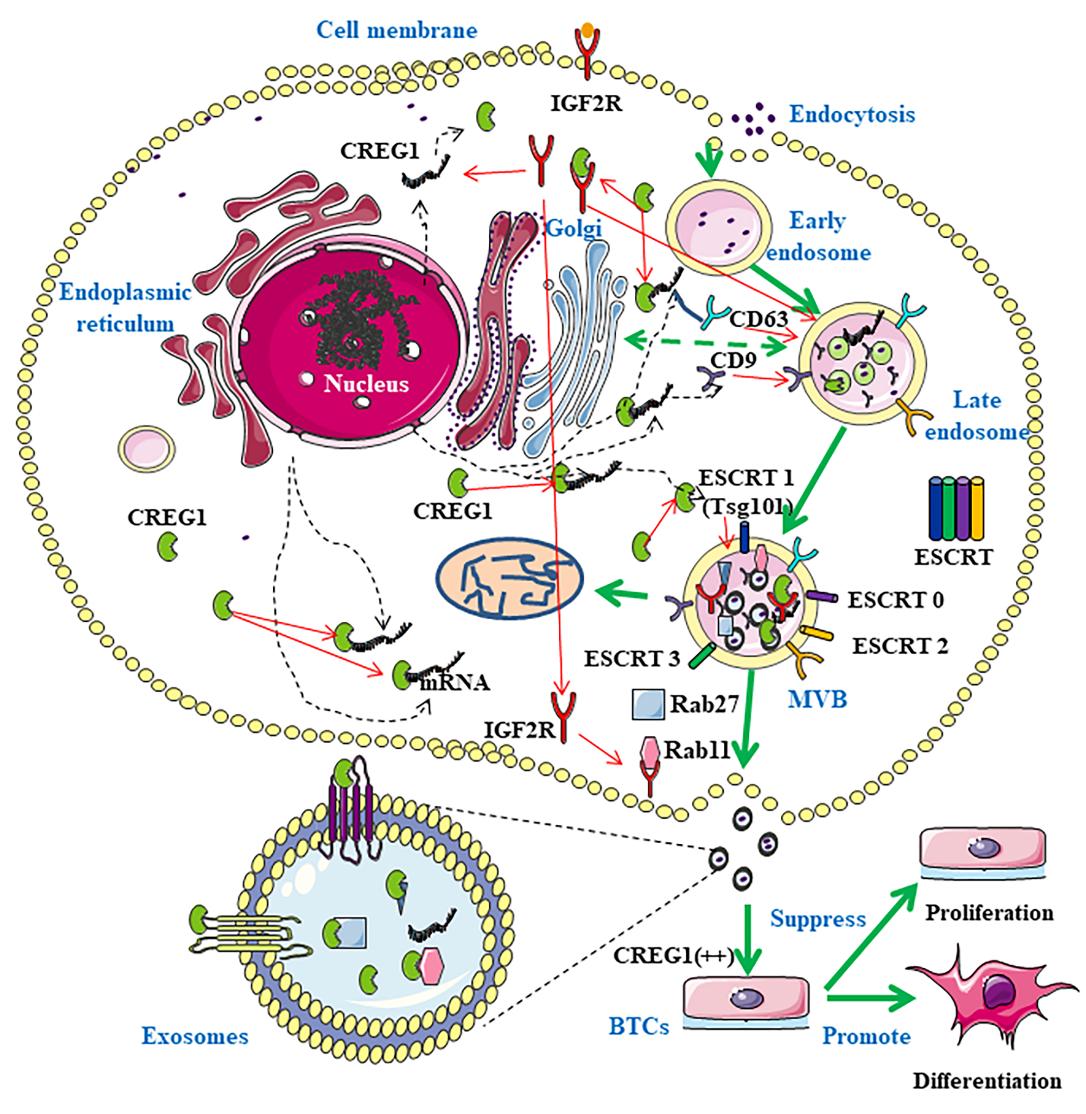
图3 CREG1调节外泌体发生和释放促进牛胎盘滋养层细胞衍生类器官分化模式图
北京农学院动物科学技术学院硕士研究生袁乃涵、青年教师肖龙菲博士为论文的共同第一作者,王相国副教授为该论文的通讯作者。北京农学院动物科学技术学院盛熙晖教授、齐晓龙副教授、郭凯军教授,北京农学院生物与资源环境学院刘冰颖博士,中国农业科学院北京畜牧兽医研究所杨晓雯研究员等参与了本项工作。
该研究得到了国家自然科学基金面上项目(32273079)和北京农学院科技创新支撑计划(BUA-HHXD2023)等资助。
论文链接:https://www.sciencedirect.com/science/article/abs/pii/S0141813024041035